病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)是触发免疫炎症反应的关键因子,其中细菌DNA中未甲基化的CpG序列作为典型的PAMPs,在感染过程中常见于血浆中,但其激活免疫受体的分子机制尚未完全明确。

2025年9月10日,我校罗施中教授课题组在《Proceedings of the National Academy of Sciences of the United States of America》发表了题为“CpG-A induces liquid–liquid phase separation of HMGB1 to activate the RAGE-mediated inflammatory pathway”的研究论文,提出了一种新机制:胞外生物分子的相分离可驱动胞内信号分子的相分离,从而实现免疫信号的快速高效跨膜转导。
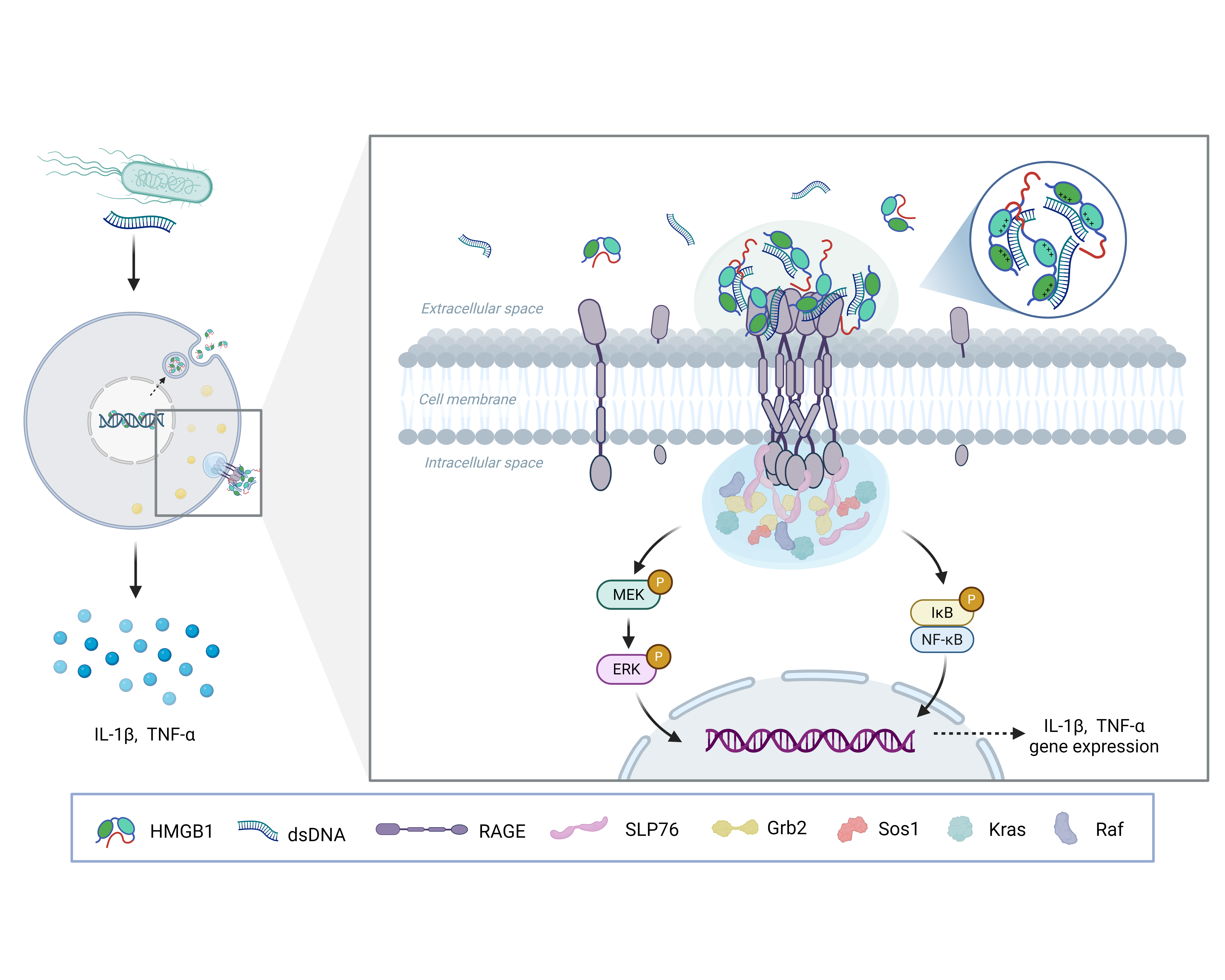
图1. 双链DNA诱导HMGB1相分离激活巨噬细胞中RAGE介导炎症信号通路的模型
该研究发现细菌DNA模拟物CpG-A可与危险信号分子HMGB1在胞外形成液-液相分离(LLPS)凝聚体,进而通过结合糖基化终末产物受体RAGE,诱导其胞质结构域与下游信号蛋白SLP76形成复合物,激活MAPK信号通路并促进炎症因子的释放(图1)。此外,内毒素LPS作为协同配体可增强HMGB1-RAGE复合物的相分离潜能,而SLP76液滴进一步富集Grb2、Sos1等关键信号因子,形成功能性信号平台,加速炎症信号级联反应。
综上所述,这一发现不仅加深了我们对HMGB1在感染和炎症中作用的理解,也为解释病原DNA触发免疫反应提供了新的分子机制,同时为相关炎症性疾病的干预策略开辟了新思路。北京化工大学生命科学与技术学院绿色生物制造全国重点实验室罗施中教授与北京化工大学软物质与高精尖中心李晋萍教授为本文的通讯作者,博士生彭凯慧为第一作者,北京化工大学为论文第一完成单位。
作者介绍:
罗施中,北京化工大学教授,博士生导师,国家级高层次人才,国家重点研发计划项目首席。本科和博士毕业于清华大学化学系,并荣获清华大学优秀博士学位论文奖,随后在美国德克萨斯大学从事博士后科研工作。2008年以高层次引进人才的方式进入北京化工大学生命学院工作,长期致力于药用多肽的生物合成与活性表征、蛋白质相变和聚集的分子机制与功能相关的基础理论和技术创新研究。以通讯作者在PNAS、Nature Communications和Science Advances等著名杂志上发表SCI论文五十余篇。担任北京化工大学学术委员会委员,塔里木大学客座教授,中国生化制药协会多肽分会专家委员会委员和Supramolecular materials编委。荣获北京市科学技术三等奖,北京市科技新星,北京市课程思政教学名师,中国国际多肽大会Young Peptide Scientist Award等奖励。
