2025年3月20日,绿色生物制造国家重点实验室、北京化工大学冯越团队与美国加州大学Joseph Bondy-Denomy团队合作在Cell上发表题为Jumbo phage killer immune system targets early infection of nucleus-forming phages的研究论文。该研究发现了细菌中首个针对巨型噬菌体的防御系统 “jumbo phage killer”(简称Juk),并揭示其工作机制,为细菌抗巨型噬菌体系统研究提供了方向。
噬菌体作为一种感染细菌的病毒,长期以来进化出一系列精巧的机制以确保其能高效地利用宿主细胞资源供自身生存。为了抵御噬菌体感染,细菌发展出了复杂多样的抗噬菌体防御机制。同时,噬菌体和细菌之间的“军备竞赛”也推动了噬菌体发展出多种反防御机制,使得这一微生物世界中的相互作用变得愈加复杂。随着对这些防御和反防御机制的深入研究,科学家们逐步揭示了细菌如何通过多种防御系统应对噬菌体的挑战以及噬菌体的反制措施,展示了这一微观世界中令人惊叹的多样性和适应性。然而,尽管目前已有上百种抗噬菌体防御系统被报道,但针对phiKZ类巨型噬菌体(Jumbo phage,即基因组>200 kb的噬菌体)的细菌防御机制仍未得到充分研究。
在本研究中,研究团队首先确定了Juk系统由两部分组成,包括JukA和JukB。他们发现JukA是一种传感器蛋白,能够快速识别噬菌体感染过程中早期表达的噬菌体蛋白gp241。在感染发生的初期,JukA会迅速与gp241结合,并定位到噬菌体感染的位置,继而激活JukB效应器的作用3。JukB的功能是什么呢?冯越团队通过X射线晶体学成功解析了JukB蛋白的结构:该结构为四聚体,并在中间呈现一个带负电的孔状结构。有意思的是,JukB的结构与苏云金芽孢杆菌成孔毒素Cry3A高度类似,而Cry3A的功能则是通过在昆虫肠道细胞膜上形成孔洞,以破坏细胞功能,从而导致昆虫死亡。值得一提的是,为了免受细菌CRISPR-Cas等核酸酶的进攻,以phiKZ家族为代表的巨型噬菌体在感染细菌过程中会组装起一个由脂类包裹的早期噬菌体感染(EPI)囊泡以及由蛋白质组成的类核结构用以保护自身基因组。根据JukB与成孔毒素结构上的相似性,冯越团队猜想JukB是否也会像Cry3A破坏昆虫肠道细胞膜一样,类似地破坏EPI囊泡的稳定性呢?随后,冯越团队通过体外生化实验进一步确定了JukA、JukB和噬菌体蛋白gp241可形成三元复合物,并通过脂质体-钙黄绿素渗漏实验验证了该复合物可以在体外有效地破坏模式脂质体,提示JukB可能会类似地破坏 EPI囊泡。通过破坏EPI囊泡,JukB可使噬菌体DNA暴露在细菌细胞质中的核酸酶下,从而抑制噬菌体基因的复制和表达。最后,合作团队证明Juk系统可以有效地抑制大多数噬菌体基因表达、噬菌体DNA复制和噬菌体核组装。
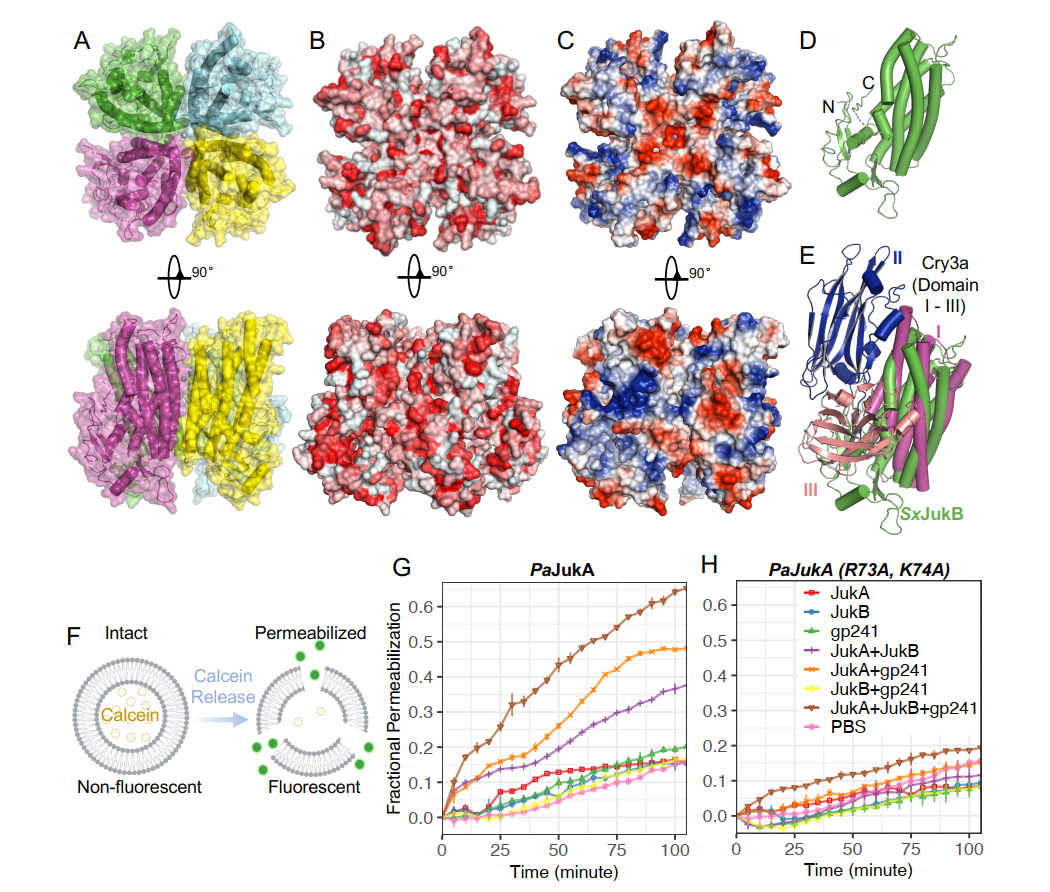
图 JukB的四聚体结构及其破坏早期噬菌体感染(EPI)囊泡
综上所述,本文发现并解析了一种全新的细菌抗噬菌体系统——Juk的作用机制。Juk作为一种广泛存在的免疫系统,其可以在感染早期特异性检测phiKZ类巨型噬菌体,阻断噬菌体的复制,并使宿主细胞继续分裂,这与多数免疫系统的流产感染属性形成鲜明对比。噬菌体和细菌之间的“军备竞赛”一直是微生物学领域研究的热点。关于Juk免疫系统的发现和研究展现了细菌在面对巨型噬菌体这些复杂病毒时的独特防御能力,这不仅帮助我们更好地理解细菌如何应对噬菌体的侵袭,并可能为开发新型抗菌策略提供重要线索。
加州大学旧金山分校李玉萍博士和北京化工大学硕士研究生关琳琳分别为本文的第一和第二作者,北京化工大学冯越教授、加州大学旧金山分校Joseph Bondy-Denomy教授和李玉萍博士为本文的共同通讯作者。
作者介绍:
冯越,北京化工大学教授,博士生导师。2013年博士毕业于清华大学,同年进入北京化工大学工作。冯越课题组多年来一直以生物化学与分子生物学、结构生物学、细胞生物学等为手段,对微生物与宿主免疫系统相互作用等领域相关蛋白质的结构与功能开展研究。共发表通讯作者(含共同)SCI论文32篇,分别发表在Nature(2篇)、Cell(2篇)、Nat Chem Biol(3篇)、Mol Cell(3篇)、PNAS、Nat Plants、Nat Commun(2篇)、Nucleic Acids Res等期刊。曾获全国青年岗位能手(2020)、青年北京学者(2024)、霍英东教育基金会第十九届高等院校青年科学奖(2024)、北京市优秀青年人才(2020)、中华医学科技奖二等奖(2024)、中国十大新锐科技人物(2018)、北京市科技新星(2019)、北京高校青年教师教学基本功比赛优秀指导教师奖(2023)等。
