2023年2月8日,国际顶级学术期刊《细胞》在线发表了题为“Flux Regulation through Glycolysis and Respiration is Balanced by Inositol Pyrophosphates in Yeast”的研究论文。北京化工大学软物质科学与工程高精尖创新中心客座教授Jens Nielsen教授和生命科学与技术学院的刘子鹤教授为该文共同通讯作者,生命科学与技术学院谭天伟教授参与该研究工作。北京化工大学秦宁博士为第一作者,北京化工大学为第一完成单位。中国科学院天津工业生物技术研究所夏建业研究员为代谢通量的测定提供了大力支持。本研究工作得到科技部国家重点研发计划、国家自然科学基金委及北京化工大学中央高校基本科研业务费的大力资助。

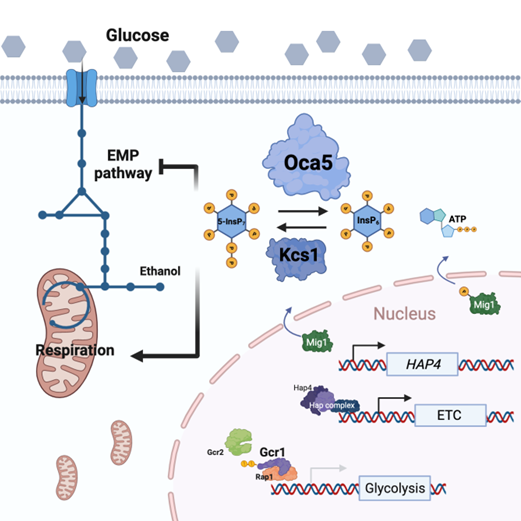
糖酵解是细胞中最古老且最基本的代谢途径。在原核生物中,糖酵解途径呈现趋异进化(EMP途径, ED途径, PK途径)而真核生物呈现趋同进化(只有EMP途径)。之前有研究在大肠杆菌中构建了非氧化型糖酵解途径,实现了糖酵解途径的替换。那么,真核生物中的糖酵解途径是否也可以替换为其他途径?如果可行,真核细胞又是如何适应这种代谢压力的?研究人员首先阻断了酵母的EMP途径,并进行了实验室自适应进化实现了真核模式生物酿酒酵母的糖分解代谢这一代谢基础的改动和替换,证明了真核生物中心碳代谢网络结构的可塑性。经过全基因组测序等系统生物学解析以及反向验证后,确定了MTH1,HXK2,OCA5三个突变位点。其中OCA5功能未有报导,研究人员在野生型酵母中敲除了OCA5并发现糖酵解的通量轻微下降但呼吸链的通量显著提升。研究人员通过系统发育树等分析,发现OCA5与其他OCA蛋白家族成员关系较远,但对OCA5和OCA3的蛋白结构进行比较显示了二者结构和可能的功能类似。OCA3之前被鉴定为肌醇焦磷酸酶,其催化形成的肌醇焦磷酸盐是影响生物过程的重要细胞信使。那么OCA5是否也是一种肌醇焦磷酸酶呢? 其对生物过程通过何种机制进行调控?
研究人员分别在体外和体内验证了OCA5可以催化5-InsP7到InsP6,即OCA5是一种新的肌醇焦磷酸酶。进一步研究显示,OCA5和OCA3均可以在丙酮酸脱羧酶缺失菌株中解除葡萄糖引发的呼吸抑制。同时,研究人员在毕赤酵母 (crabtree negative) 中也证明了OCA5的敲除可以提高线粒体总量,提示OCA5的功能并不局限于crabtree positive的酿酒酵母。表明磷酸肌醇分子对呼吸和糖酵解的代谢的调节是一个超出crabtree effect的更为基础和深远的影响机制。通过转录组学分析以及验证实验研究人员指出5-InsP7很可能是通过Gcr1和Hap4两个转录因子来实现对呼吸和糖酵解的中心调控的,而其中Gcr1可以被5-InsP7焦磷酸化已被证实。Hap4转录因子的表达提升极有可能是通过Mig1的亚细胞定位所影响,且该过程是不依赖于Snf1信号机制。该结果表明除被广泛研究的AMPK 信号途径和mTERC信号途径以外,InsP6作为ATP的能量感应器,可以对细胞的代谢通过转录因子控制中心碳代谢宏观扰动的方式来实现能量代谢的调节。该结果加深了研究人员对磷酸肌醇能量代谢机制的认识。呼吸和代谢通量的相互调节也是癌症治疗的一个重要研究方向。OCA蛋白家族内部差异极大的系统发育分析结果表明在真核生物中肌醇焦磷酸分布的隐蔽性。目前为止,在高等真核生物中尚未有肌醇焦磷酸酶的发现。该结果很可能也揭示了一个挖掘癌症机制及其治疗靶点的潜在方向。
除上述对磷酸肌醇重要机制的拓展与完善外,该论文还证明了混合型糖酵解酵母作为新型底盘细胞工厂的重要应用意义,对生产以乙酰辅酶A为前体的化学品具有巨大潜力。研究人员以脂肪酸的生产为例探索混合型糖酵解酵母的潜力并最终实现了2678 mg/L的产量,这是迄今为止使用酿酒酵母的摇瓶发酵条件生产脂肪酸的最高产量,以及酿酒酵母生产游离脂肪酸所报道的最高底物得率。同时,混合型糖酵解酵母和OCA5突变的引入使得菌株的中心碳代谢发生重塑,避免了在高浓度葡萄糖产生的溢流代谢,将大大简化其补料控制过程,节约下游发酵过程的人力物力投入,具有重要的工业应用价值和商业竞争力。
该研究解释了焦磷酸肌醇作为能量传感器调控平衡糖酵解和呼吸通量的重要机制,并提供了酵母如何在能量短缺压力下通过调节转录因子影响代谢可塑性的见解。同时,该研究证明了混合型糖酵解酵母作为新型细胞工厂底盘的应用潜力。后续相关工作还在继续开展,在酵母细胞工厂领域有意从事合作研究或博士后研究的科研工作者欢迎联系刘子鹤老师(zihe@mail.buct.edu.cn)。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00044-2
通讯作者简介:刘子鹤,北京化工大学生命科学与技术学院教授、博士生导师,国家级青年人才。主要研究方向为合成生物学工具开发、细胞机制解析、第三代生物炼制细胞工厂的开发等。共发表SCI论文43篇,其中近5年共发表一作通讯作者文章22篇,包括Cell, Nature Catalysis, Nature Communications, PNAS等,并主持包括国家重点研发计划重点专项课题在内的国家及省部级科研项目9项。
