CRISPR-Cas系统是原核生物抵御外来噬菌体入侵的一种获得性免疫防御系统。根据Cas效应蛋白的组成,CRISPR-Cas系统分为Class 1和Class 2。Class 1系统(进一步分为I、III和IV型)的效应蛋白由多个亚基的效应复合物组成,而Class 2系统(II、V和VI型)的效应蛋白为单个蛋白。在这些类型中,III型CRISPR-Cas系统因其复杂精密的免疫机制和对入侵者RNA以及DNA的切割而备受关注。III型系统识别入侵的RNA分子,并进一步分为III-A到III-F型。
Makarova等在2019年通过生物信息学分析报道了III-E型CRISPR-Cas系统1,在该系统中,4个Cas7结构域和一个类似Csm2/Cmr5的小亚基(Cas11)融合成一个大的蛋白质,被命名为gRAMP。在III-E型CRISPR-Cas系统的基因cluster中,III型系统标志性的Cas10以及csm4/cmr5基因缺失,表明它的免疫机制会有所不同。后续研究发现,III-E型系统能将前体crRNA加工成成熟的crRNA,并将靶RNA以6个核苷酸为间隔进行切割,且没有RNA旁切效应,有望成为一种高特异性的RNA编辑工具2, 3。而且有趣的是,III-E型的效应蛋白gRAMP能稳定地与caspase样蛋白酶TPR-CHAT形成一个更大的复合物(被命名为Craspase),它被推测是可通过III-E型效应蛋白识别靶RNA而被激活的蛋白酶。然而,该蛋白酶活性没有被证实,TPR-CHAT的底物也是未知的。此外,III-E型CRISPR-Cas系统的免疫机制也仍然是个谜。
2022年10月27日,北京化工大学冯越教授课题组与清华大学杨茂君教授课题组合作在Molecular Cell在线发表了题为Target RNA activates the protease activity of Craspase to confer antiviral defense的研究论文。该项工作报道了来自Candidatus "Scalindua brodae"的gRAMP-crRNA及Craspase的一系列结构,发现CTR (cognate target RNA)诱导Craspase中的TPR-CHAT发生显著的构象变化,并揭示了CTR激活Craspase的蛋白酶活性切割底物蛋白Csx30,从而触发细菌的顿挫感染(abortive infection)作为III-E型系统的抗病毒策略。

课题组首先通过对gRAMP-crRNA以及gRAMP-crRNA-TR (target RNA) 结构的分析,发现gRAMP中D547以及D698/D806分别负责靶RNA中site 1和site 2的切割。值得注意的是,gRAMP的Cas7.4结构域中的插入结构域(insertion domain)在电镜数据中的密度较差,并且insertion domain缺失的gRAMP突变体显示出对靶RNA切割活性的缺失,以及较弱的pre-crRNA加工活性。这表明插入结构域可能参与了gRAMP的前体crRNA加工,这一点与来自Desulfonema ishimotonii物种的gRAMP存在差异4,这可能反映了不同物种III-E型效应蛋白的机制差异。
那么,TPR-CHAT的蛋白酶活性是否能被激活以及蛋白酶靶向的底物是什么?课题组接下来把研究的重点放在了Craspase上,对Craspase自身以及与TR/CTR/NTR (non-cognate target RNA)结合后四种状态下的结构进行了解析。结构比对发现,Craspase与CTR结合(即靶向“非我”RNA)后会引起TPR-CHAT中包括活性位点在内的区域显著的构象变化,而TR/NTR则不能引起这样的变化。这表明,Craspase中TPR-CHAT的蛋白酶活性可能被CTR的结合所激活。
为了寻找TPR-CHAT的底物,课题组对III-E型的基因cluster进行了分析,在该cluster中通常有三个保守的辅助基因,分别是Csx30、Csx31和一个Sigma因子E(σE)编码SbRpoE。蛋白酶活性实验表明,在CTR存在的情况下,Craspase可以切割Csx30,但不能切割SbRpoE,并且Craspase对Csx30的蛋白酶活性不能在TR或NTR存在的情况下被激活。由于Csx31单独不能纯化到均一状态,所以没有对单独的Csx31蛋白进行酶切检测。同时,他们还发现Csx30、Csx31和SbRpoE可形成一个复合物,激活的Craspase也可以该复合物作为底物,切割其中的Csx30蛋白。
为了研究CTR激活的Csx30切割的生物学意义,课题组将编码gRAMP、TPR-CHAT、Csx30、Csx31和SbRpoE的基因以及含有针对dsDNA噬菌体lambda(λ)基因转录物序列的合成CRISPR array转化到大肠杆菌中,进行λ噬菌体侵染实验以及细菌体内诱导生长实验。实验结果表明,该系统能够赋予大肠杆菌抗λ噬菌体的活性,并且采用的机制为顿挫感染。同时,Craspase识别CTR而触发的对Csx30的切割对细胞有毒性,切开的Csx30的两段与Csx31和SbRpoE在大肠杆菌中共表达时会抑制大肠杆菌的生长。
基于以上的研究,课题组提出了III-E型免疫系统的分子机制模型,即Craspase中的TPR-CHAT本身处于失活状态,而噬菌体来源的核酸转录出的RNA结合在Craspase后诱导TPR-CHAT的构象变化并激活其活性,TPR-CHAT识别底物Csx30并进行切割,从而在Csx31和SbRpoE存在下引发细菌的顿挫感染(图1)。然而,Csx30的切割在Csx31和SbRpoE存在的情况下共同诱发细胞死亡的详细机制仍有待后续研究。
北京化工大学博士研究生刘茜、清华大学博士后张来幸、北京化工大学博士研究生王浩、硕士研究生修瑀,黄玲,高政宇为本论文的共同第一作者。冯越教授为本文的通讯作者和 Lead Contact,清华大学杨茂君教授和张来幸博士为本文的共同通讯作者,北京化工大学为第一完成单位。
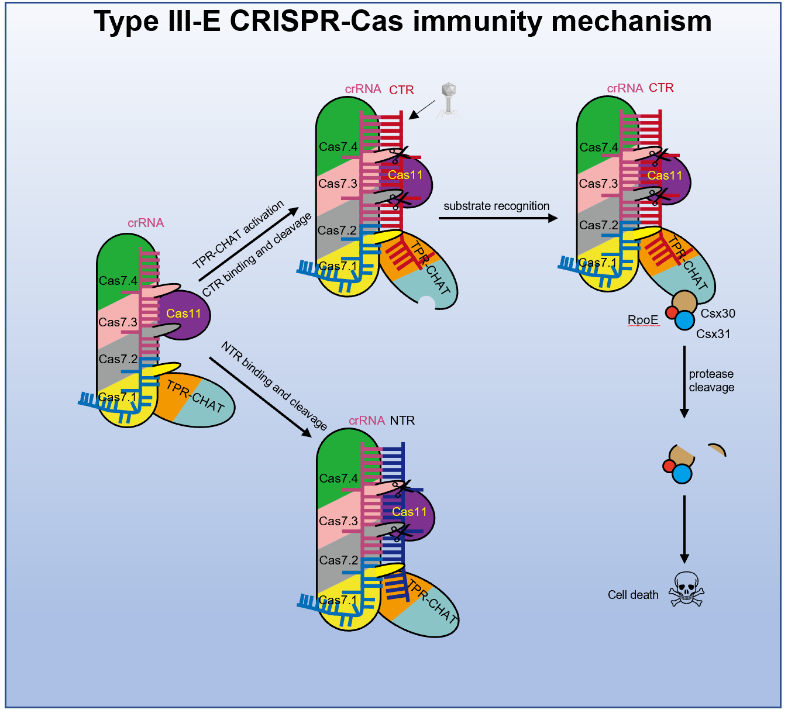
图1. III-E型CRISPR-Cas系统的免疫机制模型
参考文献
1.Makarova, K.S. et al. Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nat Rev Microbiol18, 67-83 (2020).
2.Ozcan, A. et al. Programmable RNA targeting with the single-protein CRISPR effector Cas7-11. Nature597, 720-725 (2021).
3.van Beljouw, S.P.B. et al. The gRAMP CRISPR-Cas effector is an RNA endonuclease complexed with a caspase-like peptidase. Science373, 1349-1353 (2021).
4.Kato, K. et al. Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex. Cell185, 2324-2337 e2316 (2022).
