一、研究背景:
裂解肽是一类具有细胞膜裂解能力的多肽,早期从天然产物中提取出的裂解肽具有较高的抗菌活性,被称为抗菌肽(AMPs)。随着对AMPs研究的深入,研究者发现一些广谱AMPs具有对癌细胞的活性,因此对抗肿瘤肽(ACPs)的研究也得到了越来越多的关注。
目前临床上使用较为广泛的化疗药往往会引发严重的副作用、容易发生耐药性,尤其对于前列腺癌、膀胱癌、肾癌、胰腺癌及转移后的癌症疗效较差。而ACPs直接裂解癌细胞膜,极大地降低了耐药的可能性,且由于癌细胞比正常细胞膜更低的电位,某些ACPs具有对肿瘤细胞膜的选择性。但是天然的线性ACPs往往稳定性较差,在体内易于被多种酶水解,部分ACPs对于正常细胞也会有非特异性的裂解。
二、文章简介:
针对ACPs的这些缺陷,北京化工大学生命科学与技术学院罗施中教授、陈龙副教授团队设计合成了一类套索样抗肿瘤肽——LASAP。在不经修饰、非天然氨基酸替换等可能造成ACPs活性丢失的前提下,结合环化与自组装策略以提高ACP的稳定性,结合靶向肽段、酶切释放与纳米自组装体的被动靶向策略以提高ACP的靶向性。相关研究成果发表在ACS Nano上。第一作者为北京化工大学博士研究生裴鹏飞,通讯作者为北京化工大学罗施中教授、陈龙副教授,中日友好医院王在副研究员。
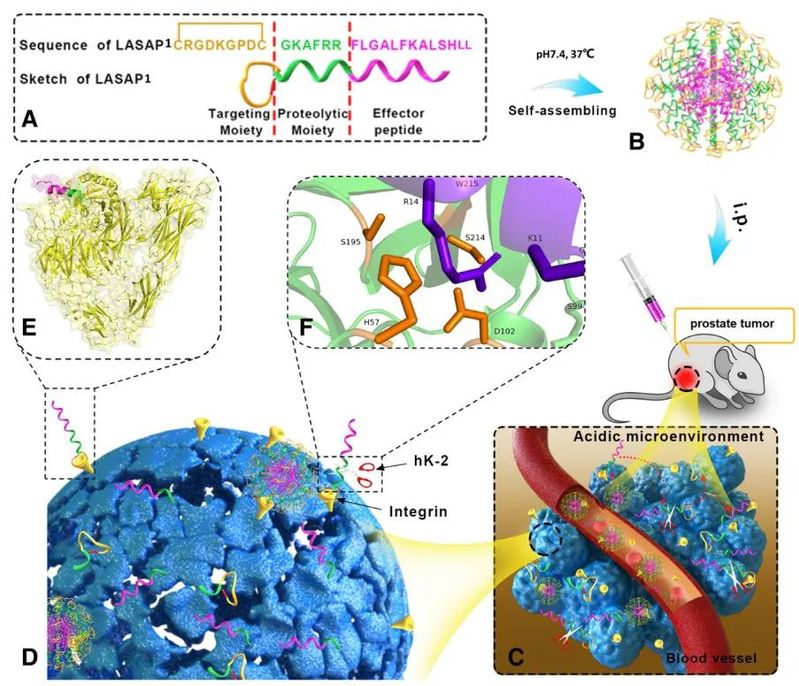
图1. LASAP的设计、递送及作用机制示意图
三、研究内容:
采用分子建模、分子对接、分子动力学模拟及结合自由能计算等手段,作者设计了一系列线性及环化的多肽分子,并对它们与靶蛋白——前列腺癌细胞表面高表达的αVβ3整合素——的结合过程、结合能力进行了预测,其中多肽的环化策略显著增强了多肽对αVβ3整合素的结合能力。

图2. 计算机辅助方法对LASAP-αVβ3相互作用及结合能力的预测
通过ELISA、荧光共定位及离体成像实验,作者分别在分子水平、细胞水平及动物水平检测了多肽对表达αVβ3整合素的前列腺肿瘤(细胞)的靶向能力。结果表明LASAP1不仅具有靶向前列腺肿瘤细胞的能力,且能通过靶向肽段iRGD实现对肿瘤细胞的内化。此外,对于前列腺癌最常见的骨转移癌细胞也具有一定的靶向能力。
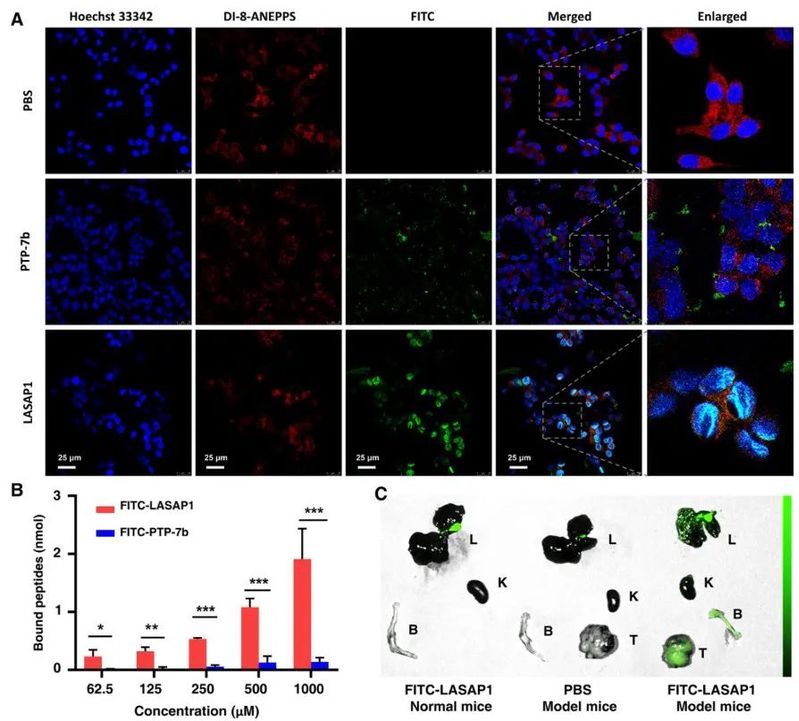
图3. LASAP1的靶向能力
人激肽释放酶hK2是一种前列腺癌细胞高表达的酶,也是前列腺癌的标志物之一。通过在LASAPs中引入hK2的酶切位点,实现了活性肽段在前列腺肿瘤微环境中的可控释放,从而裂解肿瘤细胞并提高靶向性。实验结果表明LASAP1具有hK2依赖性的细胞毒性。

图4. hK2响应性的酶切释放及细胞活性
随后,作者通过激光共聚焦显微镜确认了多肽对前列腺肿瘤细胞的裂解效果,且因为序列中的组氨酸,多肽具有pH响应性,在酸性肿瘤微环境中的活性显著增强。
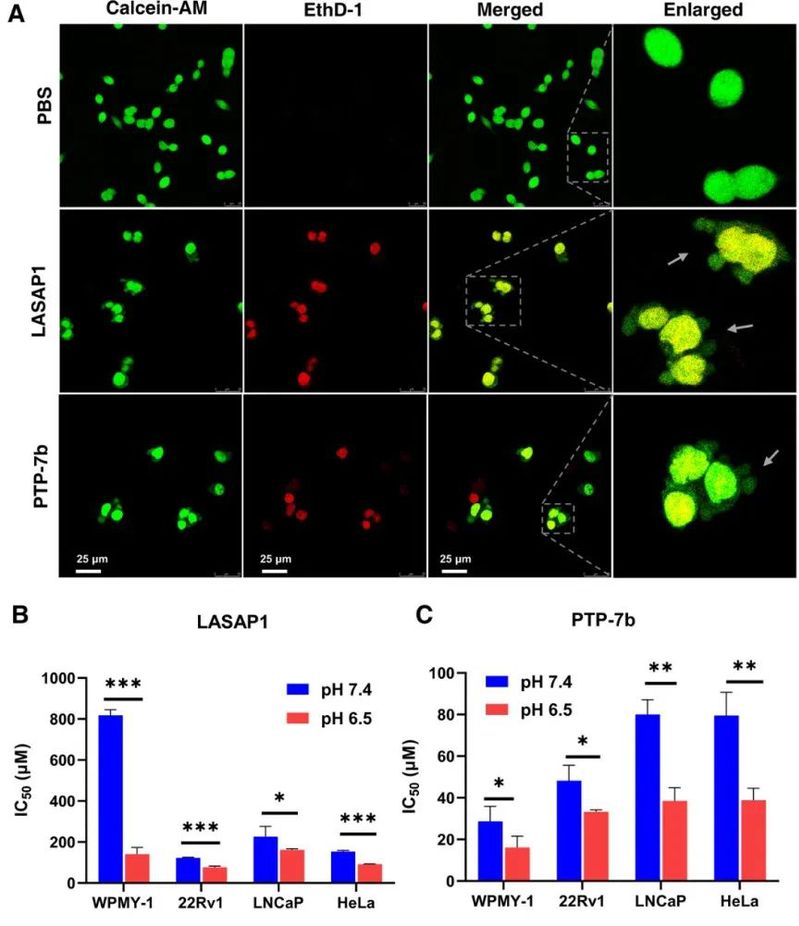
图5. 酶切释放后,多肽对肿瘤细胞的裂解及pH响应活性
四、结论与展望:
本文所提出的抗肿瘤多肽设计策略,通过多重靶向及环化、自组装结合的方式,实现了ACPs的稳定性提升、靶向性增强与可控释放,有助于解决ACPs非特异性裂解及稳定性差的限制。
五、致谢:
本工作得到了国家重点研发计划、国家自然科学基金及北化-中日生物医药转化工程研究中心联合项目等基金项目的支持,在此一并表示衷心的感谢!
