2022年3月18日,我校生命学院冯越教授课题组在《自然·化学生物学》杂志在线发表了题为AcrIF5 specifically targets DNA-bound CRISPR-Cas Surveillance Complex for inhibition的研究论文。论文报道了Csy-dsDNA-AcrIF5的冷冻电镜结构及AcrIF5蛋白的晶体结构,揭示了AcrIF5抑制I-F型CRISPR-Cas系统的分子机制。

2020年,冯越课题组即发现AcrIF5不能与Csy或者Cas2/3稳定结合,由此推测其极有可能以一种独特的方式发挥对I-F型CRISPR-Cas系统的抑制。在本研究中,冯越课题组首先利用多种方式确定了AcrIF5与Csy-dsDNA的结合,制备了Csy-dsDNA-AcrIF5的复合物样品并与清华大学杨茂君课题组合作利用冷冻电镜技术解析了该复合物的结构,同时还解析了AcrIF5的晶体结构。有趣的是,在复合物结构中,AcrIF5以五聚体的形式结合在Csy复合物中由Cas7f亚基构成的“腹部“区域,同时Cas8f亚基中负责招募Cas2/3核酸酶的螺旋束(Cas8f-HB)部分的电子密度消失。在对结构进一步分析时,他们发现AcrIF5.3/5.4会与Csy-dsDNA中的Cas8f-HB产生严重的空间位阻,因此他们推测AcrIF5可能通过将负责招募Cas2/3核酸酶的Cas8f-HB由“锁定状态”变为“自由摆动状态”而发挥抑制作用。后续的Pull-down和Cas2/3招募实验证明,AcrIF5的确可以与Cas8f-HB竞争结合Csy-dsDNA的主体,从而抑制Cas2/3的招募,由此提出了AcrIF5的工作机制(图2a)。除此之外,研究组对已知的32种含有AcrIF5基因的生物信息学分析发现,AcrIF5基因从不单独存在、而是与AcrIF3等基因共存。结合Cas2/3的招募实验,他们提出了在抑制Cas2/3招募的过程中,AcrIF3主导,而AcrIF5对AcrIF3起到功能上的补充作用的共同作用模式(图2b)。
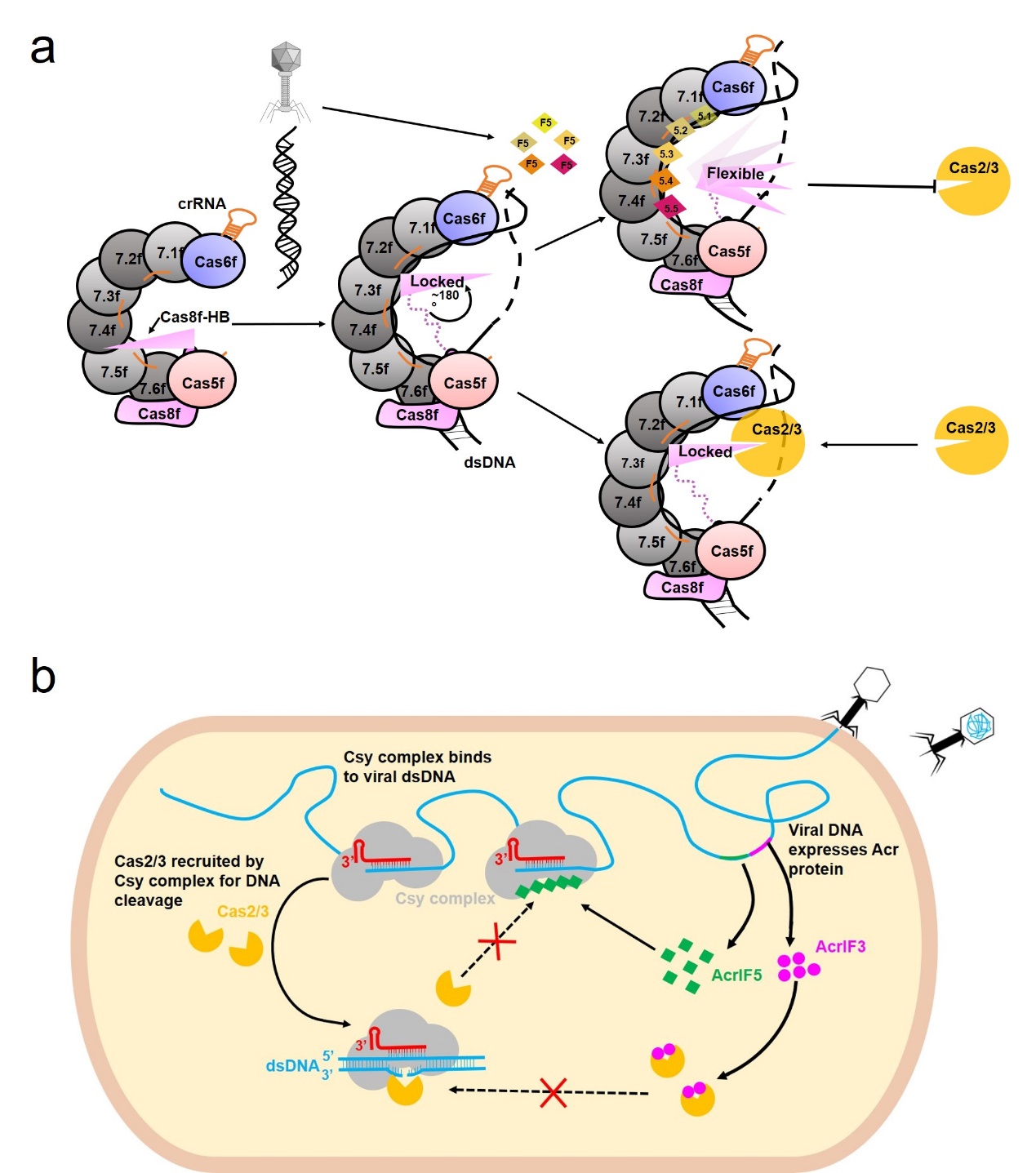
图1 AcrIF5的作用机制
北京化工大学博士生解永超、清华大学博士后张来幸、北京化工大学硕士生高政宇为本论文的共同第一作者,冯越教授为本文的通讯作者,北京化工大学为第一完成单位。清华大学杨茂君教授在电镜结构解析中提供大量指导,电镜数据和晶体衍射数据收集分别得到南方科技大学冷冻电镜中心和上海光源的大力支持。
原文链接:https://www.nature.com/articles/s41589-022-00995-8
通讯作者简介:
冯越,北京化工大学生命学院教授,博士生导师,国家优秀青年基金获得者(2018)。主要以结构生物学、生物化学以及细胞生物学等学科手段,从事病原与宿主互作的分子机制研究,先后发表SCI论文38篇,其中以通讯作者身份在《Nature》、《Nat. Chem. Biol.》、《Mol. Cell》、《Nat. Plants》、《Nat. Commun.》等杂志发表论文16篇。作为负责人主持国家及省部级项目多项。曾获得全国青年岗位能手(2020)、北京市优秀青年人才(2020)、北京市科学技术进步奖二等奖(2018)、中国十大新锐科技人物(2018)、北京市科技新星(2019)等荣誉。
