CRISPR-Cas是多种细菌和古细菌的适应性免疫系统,通过对入侵的病毒等核酸进行特异性的识别,利用Cas核酸酶进行切割,从而达到抵抗病原体的作用。在过去若干年中,CRISPR基因编辑技术在各个领域都取得了巨大进展。Emmanuelle Charpentier和Jennifer A. Doudna两位科学家也因为CRISPR基因编辑技术刚刚获得2020年诺贝尔化学奖。尽管CRISPR-Cas系统设计精妙而强大,但噬菌体也进化出了反击的方法从而逃脱CRISPR-Cas系统并成功侵染细菌。在过去的几年中,已经鉴定出多种由噬菌体和其他可移动遗传元件编码的、与CRISPR-Cas系统相互作用并使其失活的蛋白质[1],命名为“Anti-CRISPR”或Acr蛋白。这种被称为“Anti-CRISPR”的蛋白使研究人员能够对CRISPR基因编辑进行精确调控,同样具有广阔的应用前景。同时,由于长期与宿主细菌的共进化,这些抑制蛋白还很可能以独特的方式来抑制宿主的CRISPR-Cas系统,因此对其的研究在基础生物学方面也具有重要意义。
近日,我校冯越教授研究组在《Cell》经典子刊《Molecular Cell》发表题为 A Type I-F Anti-CRISPR Protein Inhibits the CRISPR-Cas Surveillance Complex by ADP-Ribosylation的研究论文,报道了I-F型Anti-CRISPR蛋白AcrIF11通过ADP核糖基化修饰抑制CRISPR系统,并阐明了该过程的分子机制。
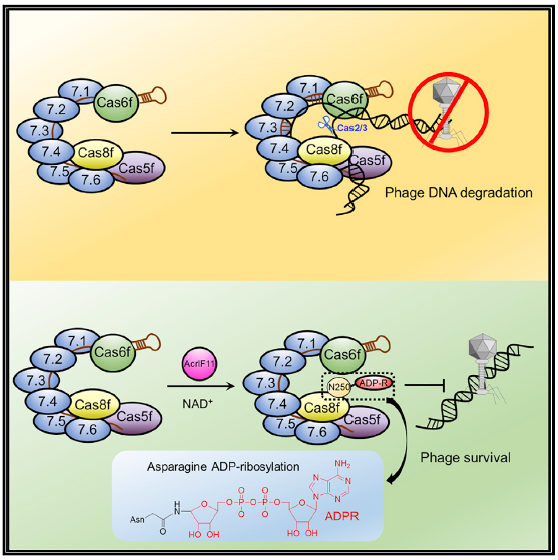
图1 AcrIF11工作机制
冯越研究组长期从事病原与宿主相互作用研究,尤其是在病原介导的蛋白质翻译后修饰方面[2-3]。在本研究中,冯越研究组首先通过分子筛结合实验来筛选不采用蛋白质相互作用这种常规的Anti-CRISPR机制的Acr蛋白。通过这种筛选手段,他们鉴定出AcrIF11,并解析了其晶体结构。巧合的是,在进行AcrIF11结晶的过程中,他们发现加入β-NAD+可以明显提高晶体的X射线衍射能力,而在后续解析结构中,他们发现AcrIF11与β-NAD+紧密结合,这为其抑制机制的研究提供了重要的结构基础。进一步的研究发现,AcrIF11具有ADP核糖基转移酶活性,它以β-NAD+为底物、特异性地对I-F型Cascade复合物中Cas8f亚基的PAM识别位点中的关键残基N250进行ADP核糖基化修饰,从而抑制Cascade复合物的DNA结合能力,使CRISPR系统失活(图1)。同时,他们还发现虽然修饰位点为Cas8f的N250,Cas8f的K247及Cas7.6f也对AcrIF11的修饰起到了不可或缺的作用。
北京化工大学硕士研究生牛艺璎、博士后杨灵光、本科毕业生高腾、沈阳农业大学硕士研究生董常鹏以及北京大学博士研究生张布雨为本论文的共同第一作者。冯越教授为本文的通讯作者和Lead Contact,北京大学刘小云教授、北京化工大学高精尖创新中心的陈泽良教授和张怡博士为本文的共同通讯作者,北京化工大学为第一完成单位。
冯越教授研究组(https://life.buct.edu.cn/2019/1031/c708a5650/page.htm)一直致力于利用结构生物学、生物化学、细胞生物学等多种手段等研究病原与宿主相互作用的分子机理。目前以通讯作者身份在Nature、Molecular Cell、Nature Communications、Nature Plants等杂志发表论文多篇。课题组长期招聘博硕士研究生及博士后,欢迎感兴趣的同学加盟或来函咨询 (forest66318@163.com)。
附冯越简介:
冯越,北京化工大学教授,博士生导师,国家自然基金委优秀青年基金获得者。研究方向为病原与宿主相互作用相关蛋白质复合物的结构与功能。共发表SCI论文30篇,其中通讯作者论文11篇,分别发表在Nature(2018)、Molecular Cell(2020)、Nature Plants(2017)、Nature Communications(2020)等国际著名期刊。曾获得全国青年岗位能手(2020)、北京市科技新星(2019)、中国十大新锐科技人物(2018)、北京化工大学校长奖(2018)、北京高校第九届青年教师教学基本功大赛一等奖(2015)等荣誉。
参考文献
[1] Maxwell, K. L. The Anti-CRISPR story:a battle for survival. Molecular Cell, 2017. 68(1): p. 8-14.
[2] Mu Y, Wang Y, Huang Y, Li D, Han Y, Chang M, Fu J, Xie Y, Ren J, Wang H, Zhang Y, Luo Z, Feng Y. Structural insights into the mechanism and inhibition of transglutaminase-induced ubiquitination by the Legionella effector MavC. Nature Communications.2020, 11(1):1774.
[3] Dong Y, Mu Y, Xie Y, Zhang Y, Han Y, Zhou Y, Wang W, Liu Z, Wu M, Wang H, Pan M, Xu N, Xu C, Yang M, Fan S, Deng H, Tan T, Liu X, Liu L, Li J, Wang J, Fang X & Feng Y. Structural basis of ubiquitin modification by the Legionella effector SdeA. Nature. 2018 May;557(7707):674-678
